Onze stofwisseling op nano-niveau.
In dit artikel begeven we ons op het kleinst mogelijke gebied van (menselijk) leven. We lichten hierbij een sluier op van hoe de machinerie binnen onze cellen functioneert. Alle processen binnen in de cel worden uitgevoerd gebeuren door eiwitmoleculen, die door kettingreacties andere eiwitten in actie brengen. Het uiteindelijke doel is of energie te gebruiken voor groei. Dat noemen we dan een anabool proces. Is er sprake van een energietekort dan schakelt het lichaam automatisch over op een katabool proces. Dan is er geen groei, maar afbraak. De opgeslagen energie (bijv. uit vetweefsel) wordt dan weer omgezet tot energie.
Eiwitten: de radertjes van ons leven.
Elke eiwit is feitelijk een heel klein robotje dan aan of uit kan staan. Vergelijk het met een lichtknop. Als het eiwit iets moet doen, dan heeft het eerst de energie nodig om tot actie over te kunnen gaan. Daarvoor moet het energie krijgen. Het moet dus als het ware eerst geladen worden om actief te kunnen worden.
Zodra het eiwit is geactiveerd kan het meestal maar één taak uitvoeren. Vaak betekent dit dat ze andere eiwitten moeten activeren. Zo kunnen ze een keten van activiteiten ontwikkelen. Dit heet een cascade. Het komt neer op het doorgeven van signalen. Daarom wordt het een ‘signaalpad’ genoemd. Soms wordt daarvoor de Engelse term gebruikt:’ cell signaling’.
Dit proces waarbij eiwitten worden geladen en informatie doorgeven, vormt als geheel feitelijk het mysterie van het leven. Met elkaar kunnen ze er voor zorgen dat een heel groot aantal voorgeprogrammeerde activiteiten kunnen worden ontplooid.
ATP: De brandstof voor alle levende wezens.
De energievorm, die nodig is om alle cel-processen te laten plaatsvinden, heet ATP. Dit vormt in elk biologisch levend wezen, zowel in het plantenrijk als het dierenrijk, de basis voor leven.
ATP staat voor Adenosine-Tri-Fosfaat. (De P staat voor het Engelse woord voor fosfaat). ATP bestaat uit een adenosine molecuul waaraan drie fosfaat groepen zijn gekoppeld. Fosfaatmoleculen zijn dus heel belangrijke als de brandstof leverancier voor de cel.
ATP wordt voor een deel gevormd, binnen de Krebs cyclus. De Krebscysluss peelt zich af in het cytosol van de cel. Daar wordt glucose omgezet naar pyruvaat . Het overgrote deel van het ATP wordt echter gevormd binnen de Mitochondriën tijdens een proces dat oxydatieve fosforylatie heet.
g
ATP levert haar energieaf aan andere moleculen doordat het een fosfaat groep afgeeft. Bijvoorbeeld aan een eiwit van het type kinase.
Met dit extra fosfaat atoom wordt het kinase voorzien van de benodigde energie om zijn specifieke taak uit te voeren.
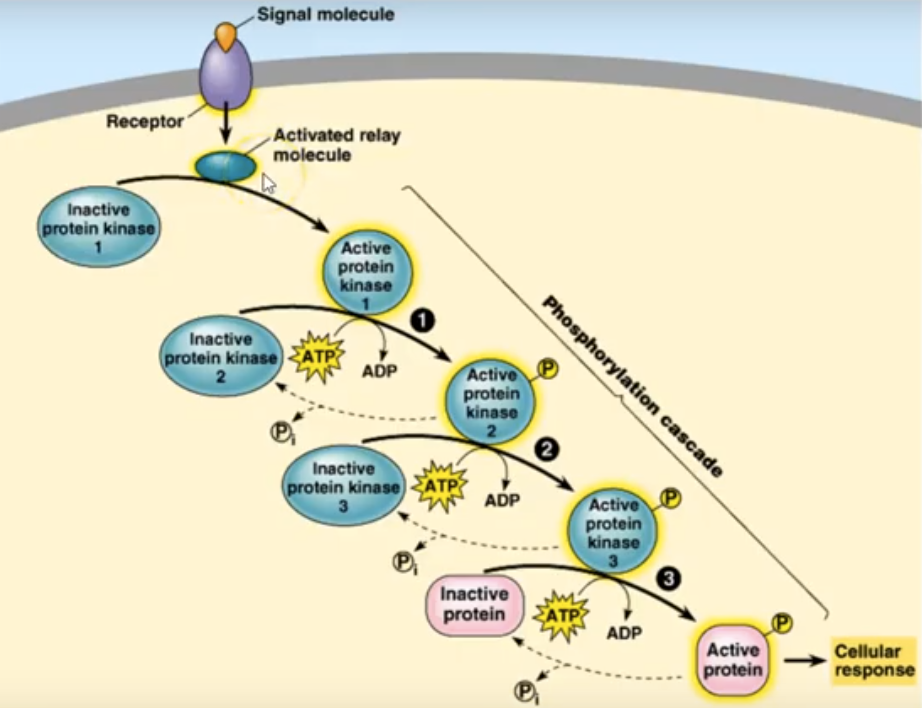
Hiernaast zien we een cascade aan reacties, die in gang gezet worden door het plakken van een geladen Fosfor atoom aan een eiwit, waardoor dit enzym de energie krijgt om zijn werking uit te voeren.
Zodra ATP een fosfaat groep heeft afgestaan transformeert het tot AdenosineDiPhosfaat (ADP) en verliest het nog een fosfaat groep dan wordt het AdenosineMonoPhosfaat (AMP). De verhouding tussen het aantal ATP en AMP moleculen bepalen de energetische toestand van een cel. Daalt de ATP/AMP ratio onder de 1, dan is de cel in nood en schakelt deze over op de katabole stofwisseling. (Dit wordt in het volgende hoofdstuk behandeld).
Energieopname tijdens de absorptieve- en postabsorptieve fase
Na een maaltijd, gebruikt het lichaam het voedsel om cellen van brandstof te voorzien. De absorptietoestand van de stofwisseling duurt ongeveer vier uur, tijdens en na elke maaltijd. In deze staat wordt verteerd voedsel omgezet in suiker of glucose. Insuline zorgt ervoor dat glucose de cellen kan binnendringen en kan worden gebruikt voor energie.
De lever slaat glucose op als glycogeen of zet overtollige glucose om in lichaamsvet voor opslag. De resterende glucose wordt in de skeletspier opgeslagen als glycogeen.
Tijdens de postabsorptieve toestand is het spijsverteringskanaal leeg en komt het lichaam in een toetand van energietekort en zal energie uit de lichaamsreserves gaan opnemen. De lever maakt van het opgelsagen glycogeen weer glucose, dat uiteindelijk weer door de lever in de bloedbaan wordt afgegeven om een normale bloedsuikerspiegel te behouden.
Celsignalering
De manier waarop meercellige organismen in staat zijn om met elkaar te communiceren is een zeer complex proces. Wetenschappers hebben in de laatste decennia steeds meer inzicht gekregen in hoe de communicatie tussen cellen verloopt. Het totaal van de communicatie tussen cellen en de daaropvolgende gebeurtenissen binnen de cel worden door het begrip celsignalering.
Dankzij de enorme toename van kennis dat werd gegenereerd door het Human Genome Project, een enorm samenwerkingsproject van tientallen laboratoria in Europa en de VS, dat uiteindelijk heeft geleid tot de ontrafeling van het menselijke DNA, heeft de biomedische wetenschap reusachtige voortuitgang geboekt.
Door die uniek samenwerking tussen Europese en Amerikaanse wisten topwetenschappers steeds meer geheimen van de celbiologie te ontsluieren.
Cellen zijn in staat door het uitzenden van groei- en signaalmoleculen om een groot scala aan functies te coördineren. Zenuwcellen moeten bijvoorbeeld kunnen communiceren met spiercellen om beweging te creëren, immuuncellen zorgen ervoor dat de eigen lichaamscellen tegen indringers van buiten af beschermd worden etc.
Tijdens de ontwikkeling van de bevruchte eicel tot een volgroeide baby, worden alle nieuwe cellen via cel-signalering geïnstrueerd en georganiseerd. Dit gebeurt zodanig dat iedere weefselsoort zijn eigen genen in het DNA activeert en de onbruikbare genen, die bij een ander weefselsoort behoren, inactiveert. Zo ontstaat een organisme met miljoenen cellen, die ieder hun eigen functie kunnen uitvoeren.
Complexe cel-signaalpaden: een sequentieel proces.
Dierlijke en plantaardige cellen zijn stuk voor stuk kleine chemische fabriekjes, waarin heel veel taken tegelijk worden uitgevoerd. Een van de belangrijkste taken die cellen uitvoeren is het produceren van eiwitten. Eiwitten of proteïnen zijn moleculen, die als het ware kleine robotjes zijn, die ieder een eigen nauw omschreven taak zelfstandig kunnen uitvoeren. Deze processen verlopen sequentieel, dat betekent dat elke volgende stap pas kan worden uitgevoerd als alle voorgaande stappen nauwkeurig volgens een vastomlijnd traject zijn verlopen.
Om te kunnen reageren op veranderingen in hun directe omgeving, ontvangen cellen signalen, die van buiten hun omhulsel, de celmembraan, naar hen toe komen. Deze signalen worden vrijwel altijd opgevangen via speciale receptoren, die op of in de celmembraan van de ontvangende cel liggen. Deze receptoren reageren uitsluitend op bepaalde moleculen of hormonen waar ze een verbinding mee kunnen vormen. Ze zijn dus heel specifiek.
Individuele cellen ontvangen vaak veel signalen tegelijkertijd en integreren vervolgens de informatie die ze ontvangen in een uniform actieplan. Cellen zijn niet alleen ontvangers van signalen, ze sturen zelf ook berichten naar andere cellen, zowel dichtbij als veraf.
De signalen die ze ontvangen worden binnen in het cytosol (het vloeibare binnenste van de cel) via een aantal ingewikkelde chemische reacties, met andere eiwitten, die we het signaalpad noemen, doorgegeven aan boodschappers. Deze boodschappers moeten de signalen overbrengen naar het DNA. Deze boodschappers zijn de transcriptiefactoren, dit zijn speciale moleculen die in de celkern actief zijn. Deze transcriptiefactoren weten precies aan welke genen in het DNA de boodschap moet worden afgegeven.
Zodra deze genen aldus zijn geactiveerd beginnen ze de code aan te maken waarmee het specifieke eiwit, dat op dat moment gevraagd wordt, kan worden geproduceerd. Dit alles volgt op het signaal van buiten af wat de cel heeft ontvangen.
Wat voor signalen ontvangen cellen?
De meeste cel-signalen zijn chemisch van aard. Prokaryotische organismen, zoals bacteriën, hebben bijvoorbeeld sensoren die voedingsstoffen detecteren en hen helpen in de richting van voedselbronnen te navigeren. In meercellige organismen, zoals de menselijke cellen, zijn groeifactoren, hormonen, neurotransmitters en extracellulaire matrixcomponenten enkele van de vele soorten chemische signalen die cellen gebruiken. Deze stoffen kunnen lokaal hun effecten uitoefenen, maar ze kunnen ook op afstand werken.
Neurotransmitters zijn bijvoorbeeld een klasse van signaalmoleculen met een kort bereik die zich verplaatsen in de kleine ruimtes tussen aangrenzende neuronen of tussen neuronen en spiercellen. Andere signaalmoleculen moeten veel verder gaan om hun doelen te bereiken. Een voorbeeld is follikelstimulerend hormoon (FSH), dat zich verplaatst van hypofyse in de de hersenen van zoogdieren naar de eierstok, waar het de rijping en afgifte van eicellen veroorzaakt.
Sommige cellen reageren ook op mechanische stimuli. Zintuiglijke cellen in de huid reageren bijvoorbeeld op de druk van aanraking, terwijl vergelijkbare cellen in het oor reageren op de beweging van geluidsgolven. Bovendien detecteren gespecialiseerde cellen in het menselijke vaatstelsel op veranderingen in bloeddruk, dat weer informatie is die het lichaam gebruikt om een constante hartbelasting te behouden.
Hoe herkennen cellen deze signalen?
Cellen hebben eiwitten die receptoren worden genoemd. Deze binden aan signaalmoleculen en kunnen dan een cascade (opeenvolging van gebeurtenissen) aan chemische reacties initiëren. Er bestaan verschillende receptoren, die ieder weer specifiek zijn voor verschillende moleculen.
Dopamine-receptoren binden dopamine, insuline-receptoren binden insuline, zenuwgroeifactor-receptoren binden zenuwgroeifactor, enzovoort. In feite zijn er honderden receptor typen in cellen, en verschillende celtypen hebben verschillende populaties van receptoren.
Receptoren.
Dit zijn over het algemeen transmembraaneiwitten, dat wil zeggen dat ze als het ware een poortje in de celmembraan vormen waardoor alleen de bij de receptor behorende signaalmoleculen door de celmembraan kunnen worden doorgelaten, waardoor een verbinding kan worden gemaakt maken met andere moleculen binnen de cel die de signaal-casade of het signaalpad in werking stellen. Dit doen ze door het signaal via een reeks moleculaire schakelaars naar interne signaalwegen in de celkern over te brengen.
Membraanreceptoren worden in drie hoofdklassen ingedeeld: a) G-eiwit-gekoppelde receptoren, b) ion-kanaalreceptoren en c) enzymgebonden receptoren. De namen van deze receptorklassen verwijzen naar het mechanisme waarmee de receptoren externe signalen omzetten in interne signalen – respectievelijk via eiwitwerking, ion-kanaalopening of enzymactivering.
Omdat membraanreceptoren een interactie aangaan met zowel extracellulaire signalen als moleculen in de cel, stellen ze de signaalmoleculen in staat om de celfunctie te beïnvloeden zonder dat ze daadwerkelijk de cel binnen te gaan. Dit is belangrijk omdat de meeste signaalmoleculen ofwel te groot of te geladen zijn om het plasmamembraan van een cel te passeren (figuur 1).
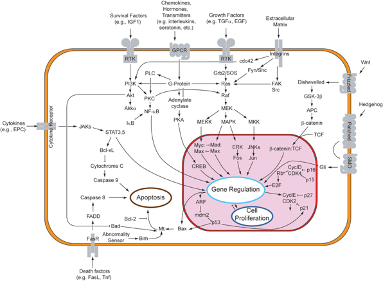
Fig.1: Illustratie met een aantal voorbeelden van signaalpaden in een cel. Verschillende soorten receptoren zijn hier in de celmembraan aangegeven, die ieder op zijn beurt reageert op een signaalstof van buiten de cel en vervolgens een eigen signaalpad in werking zet. Zoals hier is te zien bestaan er vele verschillende signaalpaden, die ieder hun eigen belangrijke functie in de cel kunnen uitvoeren.
Hoe reageren cellen op signalen?
Zodra een receptor een signaal ontvangt, ondergaat het een ‘conformationele’ verandering, dat een kleine verandering in structuur van het molecule veroorzaakt, die op zijn beurt een reeks biochemische reacties in de cel veroorzaakt. De chemische reacties worden door zogenaamde kinases in gang gezet. Ze zijn onmisbare elementen in de hele casacade. Deze intracellulaire signaalpaden, ook wel signaaltransductiecascades genoemd, versterken de voor deze signaalstof typische boodschap en produceren vervolgens meerdere intracellulaire signalen voor elke gebonden receptor.
Kinasen, belangrijke spelers bij de signaaloverdracht.
Het insuline-signaalpad reguleert, zoals we nu hebben gezien, vele biologische processen, waaronder energieopslag, apoptose, transcriptie en cellulaire homeostase. Een dergelijke regulering omvat het nauwkeurig kunnen laten verlopen van tijdelijke gebeurtenissen in de netwerken van de eiwit-fosforylatie, dat het signaalpad in wezen is. Belangrijke spelers in de hele keten van gebeurtenissen zijn weggelegd voor de diverse typen kinase. Kinase zijn eiwitstructuren, die een cruciale rol spelen bij de vele signaaloverdracht processen.
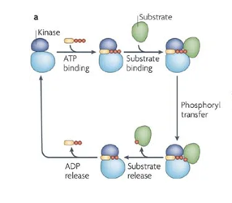
Hier links zien we hoe kinasen functioneren. Ze nemen eerst energie op in de vorm van ATP en koppelen vervolgens aan een eiwit, door er een fosfaatgroep aan te binden. Hierdoor wordt het eiwit actief en gaat het zijn functie vervullen. De kinase is in feite een katalasytor voor het laten verlopen van een reactie.
Citaat uit dit artikel “Mechanisms of specificity in protein phosphorylation”:
‘Uitgaande van hun enorme bijdrage voor de vele signaaloverdracht processen, is het niet verbazingwekkend dat de genen die proteïne-kinasen produceren een van de grootste verzameling genen in eukaryoten uitmaken. Ze maken plm. 2% uit van gehele genoom en zijn intensief bestudeerd. Verder heeft men berekend dat 30% van alle cellulaire proteïnen worden gefosforyleerd. Als we er van uit gaan dat er zo’n 10.000 verschillende eiwitten in een eukaryotische cel bestaan, met een gemiddelde lengte van ~ 400 aminozuren, dan bestaan er meer dan ~700.000 potentiele fosforylisering posities (P-sites) voor elke kinase!
“Second messengers”
Activering van receptoren zal de synthese veroorzaken van kleine moleculen die tweede boodschappers (‘second messengers’) worden genoemd, zij initiëren en coördineren de intracellulaire signaalroutes. Ca2+ en Cyclisch AMP (cAMP) zijn voorbeelden van veel voorkomende ‘second messengers’, die betrokken zij bij signaaltransductiecascades. (cAMP was de eerste ‘tweede boodschapper’, die ooit werd ontdekt.)
cAMP wordt gesynthetiseerd uit ATP door het enzym adenylylcyclase, dat zich in de celmembraan bevindt. ATP staat voor Adenosine-tri-fosfaat en is de energieleverancier voor de cel. Elke fosfaatgroep die geleverd wordt door ATP levert energie aan de ontvangende molecuul. Hiermee worden enzymen en andere signaalstoffen geactiveerd en beginnen ze hun taak uit te oefenen.
Fosforylering maakt een ingewikkelde actie van de eiwitfunctie mogelijk. Fosfaatgroepen kunnen aan meerdere plaatsen in een enkel eiwit worden toegevoegd en een enkel eiwit kan op zijn beurt het substraat voor meerdere kinasen en fosfatasen zijn.
Adenylylcyclase werkt als het ware als een snelle kopieermachine en de activering ervan kan leiden tot de vervaardiging van honderden of zelfs duizenden cAMP-moleculen. Deze cAMP-moleculen activeren op hun beurt het enzym ProteinKinase A (PKA), dat vervolgens meerdere eiwitsubstraten fosforyleert. Elke stap in de cascade versterkt het initiële signaal verder. De fosforyleringsreacties bemiddelen zowel korte- als lange termijn reacties in de cel (figuur 2). cAMP stopt met signaleren, wanneer het weer wordt afgebroken door het enzym fosfodiesterase.
Andere voorbeelden van veel voorkomende ‘second messengers’ of tweede boodschappers omvatten diacylglycerol (DAG) en inositol 1,4,5-trifosfaat (IP3), die beide worden geproduceerd door het enzym fosfolipase, dat ook een membraaneiwit is.
IP3 veroorzaakt de afgifte van Ca2 + – nog een tweede messenger – uit de intracellulaire voorraad. Samen activeren DAG en Ca2 + een ander enzym, het proteïnekinase C (PKC) genaamd.
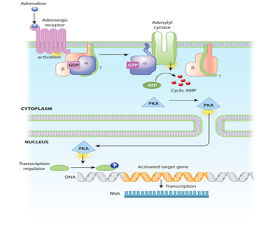
Koppeling van adrenaline initieert een cascade van reacties in de cel. De signaaltransductie cascade begint wanneer adenylylcyclase, een membraangebonden enzym, wordt geactiveerd door G-eiwitmoleculen die zijn geassocieerd met de adrenerge receptor. Adenylylcyclase creëert meerdere cyclische AMP-moleculen, die zich verspreiden en proteïnekinasen kunnen gaan activeren (ProteïneKinase A (PKA)), in dit voorbeeld). Proteïnekinasen kunnen de celkern binnendringen en de transcriptie factoren activeren, die een bepaald gen aanzet om vervolgens een actief eiwit te produceren.
Hoe beïnvloeden signalen de cel functie?
Eiwitkinasen zoals PKA en PKC katalyseren de overdracht van fosfaatgroepen, afkomstig van ATP-moleculen, naar eiwitmoleculen. Zo worden deze eiwitmoleculen geladen met energie en kunnen ze hun functie uitoefenen. In deze signaaleiwitten zijn de aminozuren serine, threonine en tyrosine veel voorkomende aanhechtingsplaatsen voor fosforylering.
Deze fosforyleringsreacties regelen de activiteit van vele enzymen die betrokken zijn bij intracellulaire signaalroutes. In het bijzonder veroorzaakt de toevoeging van fosfaatgroepen, een conformationele (ruimtelijke) verandering in de enzymen, die de enzymactiviteit kan activeren of remmen. Na gedane arbeid verwijderen proteïnefosfatasen, indien nodig, de fosfaatgroepen uit de enzymen, waardoor het effect van de enzymatische activiteit wordt omgekeerd.
Op ieder moment ontvangt en reageert een cel op tal van signalen, en meerdere signaaltransductiepaden werken tegelijkertijd in zijn cytoplasma. Er zijn veel kruispunten tussen deze paden. Een boodschapper of eiwitkinase kan bijvoorbeeld een rol spelen in meer dan één route. Via dit netwerk van signaalpaden integreert de cel voortdurend alle informatie die hij van zijn externe omgeving ontvangt.
Conclusie
Cellen ontvangen specifieke signalen in chemische vorm via verschillende signaalmoleculen. Wanneer een signaalmolecuul samenkomt met een geschikte receptor op een celoppervlak, veroorzaakt deze binding een reeks gebeurtenissen, die niet alleen het signaal naar het inwendige van de cel draagt, maar deze ook versterkt. Cellen kunnen ook signaalmoleculen naar andere cellen sturen. Sommige van deze chemische signalen – waaronder neurotransmitters – reizen slechts een korte afstand, maar anderen moeten veel verder gaan om hun doelen te bereiken, zoals bijvoorbeeld het geval is met hormonen.
Plaatje kinasen: Bron: Ubersax, J., Ferrell Jr, J. Mechanisms of specificity in protein phosphorylation. Nat Rev Mol Cell Biol8, 530–541 (2007). https://doi.org/10.1038/nrm2203
