Darmbacteriën kunnen L-Dopa, het belangrijkste medicijn voor ziekte van Parkinson, afbreken.
L-dopa, de voorloper van dopamine, wordt meestal oraal ingenomen. Het medicijn wordt geabsorbeerd in de dunne darm, en in tegenstelling tot dopamine, passeert het de bloed-hersenbarrière in de hersenen, waar het wordt omgezet in dopamine door decarboxylatie. Dopamine-vervanging vermindert de motorische symptomen van de ziekte van Parkinson, maar belet de progressie van de ziekte van Parkinson niet.
In een overzichtsartikel in ‘Science’ van 14 juni j.l. getiteld: “Gut microbes metabolize Parkinson’s disease drug” bericht Cora Neill over het onderzoek van Maini Rekdal et al. over hun bevindingen, die mogelijk van belang kunnen zijn voor de behandeling van de ziekte van Parkinson in de nabije toekomst.
Maini Rekdal et al. (3) beschrijven een tweetraps microbieel enzymatisch pad dat L-dopa tot dopamine en vervolgens tot m-tyramine degradeert, waardoor potentieel de beschikbaarheid van het geneesmiddel bij patiënten kan worden beperkt. Bovendien identificeren ze een klein molecuul dat deze L-dopa-metaboliserende bacteriële route kan blokkeren, met als doel het verhogen van de beschikbaarheid van L-dopa bij patiënten met de ziekte van Parkinson.
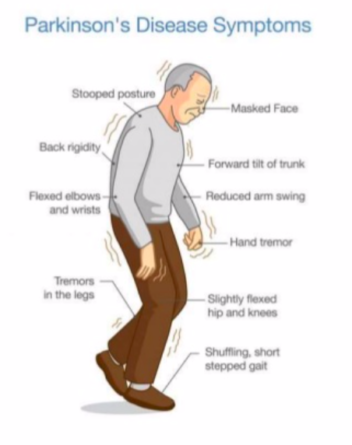
Wereldwijd leven 10 miljoen mensen met de ziekte van Parkinson en L-dopa is al meer dan 50 jaar de primaire behandeling (4). Dopamine raakt geleidelijk uitgeput in de hersenen van patiënten met de ziekte van Parkinson, doordat de dopamine producerende neuronen afsterven. Dit veroorzaakt motorische beperkingen, waaronder tremor, stijfheid en traagheid van beweging.
Parkinson begint in de darm .
De biljoenen micro-organismen die samen de darmflora vormen, bevatten een schat aan enzymen. Deze modificeren en metaboliseren rechtstreeks voedingscomponenten, geneesmiddelen en toxines, die mensen opnemen. Hoewel dit vaak gunstig is, kan de darmmicrobiota de biologische beschikbaarheid en werkzaamheid van het geneesmiddel wijzigen (1, 2). Levodopa (L-dopa), de belangrijkste medicamenteuze behandeling voor de ziekte van Parkinson, vertoont een grote variabiliteit in de interindividuele response, met verminderde werkzaamheid in de loop van de tijd.

L-dopa wordt in de darm al vroeg gedecarboxyleerd tot dopamine, voordat het in de hersenen terechtkomt (dit gebeurt met name in de darm). Dit beperkt de biologische beschikbaarheid van het geneesmiddel en veroorzaakt gastro-intestinale problemen (4). Het tegengaan van dit effect wordt bereikt door gelijktijdige toediening van perifere menselijke decarboxylase-remmers (4), zoals carbidopa. De biologische beschikbaarheid van L-dopa varieert echter aanzienlijk tussen patiënten en de werkzaamheid neemt in de loop van de tijd af, waardoor hogere doses nodig zijn met onvoorspelbare fluctuerende motorische reacties en nadelige bijwerkingen (4, 5).
Gastro-intestinale dysfunctie, waaronder constipatie, vertraagde maaglediging en bacteriële overgroei in de dunne darm, zijn sleutelcomponenten van de ziekte van Parkinson en deze verminderen de intestinale absorptie en respons op het geneesmiddel L-Dopa (5). Darmfunctiestoornissen treden meestal vóór de motorische symptomen op en verslechteren naarmate de ziekte van Parkinson vordert.
Meerdere onderzoekers hebben aannemelijk gemaakt dat de oorsprong van de ziekte van Parkinson in de darmen zou kunnen liggen (5,6). Het darmmicrobioom blijkt te zijn veranderd bij patiënten met de ziekte van Parkinson (5,6) en dit zou ten grondslag kunnen liggen aan de pathofysiologie van de darm-hersenenas (5-7), evenals het afnemende effect van de behandeling met L-dopa (5).
Het is opmerkelijk is dat het al sinds 1971 bekend is dat darmmicroben L-dopa tot dopamine en m-tyramine afbreken bij de ziekte van Parkinson (8), maar welke microben en enzymen verantwoordelijk zouden zijn voor deze uit twee stappen bestaande route moest nog worden ontdekt.
Enterobacter en Lactobaccilus kunnen L-Dopa afbreken.
Maini Rekdal et al. gebruikte translationele technieken (geïntegreerde interdisciplinaire benaderingen) om de metabole route van L-dopa te identificeren.
Voor de eerste stap, L-dopa-omzetting in dopamine, bestonden al enkele aanwijzingen dat Tyrosine-decarboxylase, voornamelijk aanwezig in de darmbacteriën van de Enterococcus- en Lactobacillus-geslachten (9-11), ook dopamine konden decarboxyleren (9, 11). Door het screenen van gevestigde gegevensreeksen van het menselijke microbioom, toonden Maini Rekdal et al. aan dat de meeste tyrosine decarboxylase (tdc) genen aanwezig waren in deze geslachten, vooral bij Enterococcus. Dit in overeenstemming met andere recente bevindingen (12). Bovendien bleken E. faecalis-soorten de meest efficiënte stammen te zijn voor het decarboxyleren van L-dopa.
Een uitleg hoe het onderzoek verder verlopen is terug te lezen in het oorspronkelijke artikel van Cora Neill.
Aanzienlijke variatie
Maini Rekdal et al. laten zien dat de enzymen die L-dopa afbreken, optreden in microbiomen uit menselijke stoelgangmonsters en dat degradatie van L-dopa optreedt met een aanzienlijke variatie bij mensen met en zonder de ziekte van Parkinson. Ze tonen aan dat afbraak van L-dopa overwegend kan worden voorspeld door microbiële tdc-genexpressie en overmatige hoeveelheid aan E. faecalis in stoelgangmonsters. Bovendien tonen recente onderzoeken aan dat hogere hoeveelheden tdc in ontlasting van Parkinson-patiënten correleren met toenemende L-dopa-dosering en ziekteduur (12).
Wat betekenen deze bevindingen voor mensen met de ziekte van Parkinson?
Een belangwekkende bevinding van Maini Rekdal et al. was de identificatie van α-fluormethyltyrosine (AFMT), een klein molecule dat als remmer van die specifieke microbiële L-dopa-decarboxylase-activiteit bleek te werken.

AFMT blokkeert de afbraak van L-dopa door E. faecalis bij muizen. Bovendien waren de L-dopa-concentraties in het bloedplasma hoger bij ratten wanneer L-dopa en carbidopa gelijktijdig werden toegediend met niet-L-dopa-metaboliserende E. faecalis-mutanten in vergelijking met actieve stammen (12). Samen geven deze bevindingen aan dat het blokkeren van bacteriële L-dopa decarboxylase-activiteit bij patiënten met de ziekte van Parkinson, met kennis van de abundantie van dit enzym in een individu, de L-dopa-therapieën zou kunnen personaliseren en mogelijk verbeteren.
Cora O’Neill, Science, 14 juni 2019: Vol. 364, Issue 6445, blz. 1030-1031 | “Gut microbes metabolize Parkinson’s disease drug”
Het originele onderzoeksartikel van Maini Rekdal et al.: (mogelijk is dit alleen zichtbaar voor abonnees van Science)” Discovery and inhibition of an interspecies gut bacterial pathway for Levodopa metabolism
Medisch Contact 2017: Nieuwe aanwijzing: Parkinson begint in de darm.
Referenties:
- P. Spanogiannopoulos, E. N. Bess, R. N. Carmody, P. J. Turnbaugh, Nat. Rev. Microbiol.14, 273 (2016).CrossRefPubMedGoogle Scholar
- G. Clarke et al., Pharmacol. Rev.71, 198 (2019).Abstract/FREE Full TextGoogle Scholar
- V. Maini Rekdal et al., Science364, eaau6323 (2019).Abstract/FREE Full TextGoogle Scholar
- S. Fahn, Mov. Disord.30, 4 (2015).CrossRefPubMedGoogle Scholar
- R. F. Pfeiffer, Curr. Treat. Options Neurol.20, 54 (2018).Google Scholar
- M. Lubomski et al., J. Neurol.10.1007/s00415-019-09320-1 (2019).Google Scholar
- E. Sherwin, T. G. Dinan, J. F. Cryan, Ann. N. Y. Acad. Sci.1420, 5 (2018).CrossRefGoogle Scholar
- M. Sandler, B. L. Goodwin, C. R. Ruthven, D. B. Calne,Nature229, 414 (1971).CrossRefPubMedGoogle Scholar
- H. Blashcko, Biochim. Biophys. Acta4, 130 (1950).CrossRefPubMedGoogle Scholar
- N. Connil et al., Appl. Environ. Microbiol.68, 3537 (2002).Abstract/FREE Full TextGoogle Scholar
- H. Zhu et al., Sci. Rep.6, 27779 (2016).CrossRefPubMedGoogle Scholar
- S. P. van Kessel et al., Nat. Commun.10, 310 (2019).CrossRefPubMedGoogle Scholar
- M. Perez et al., Appl. Microbiol. Biotechnol.99, 3547 (2015).CrossRefPubMedGoogle Scholar
